加强药品研发知识产权保护落实药品试验数据保护制度
证券时报两会报道组
今年两会,全国人大代表、人福医药(600079)董事长李杰将再次携多份建议、议案上会。
作为行业代表,此前两会李杰曾提出重视原料药绿色环保工艺开发,给研发“创新药”特定税收优惠等多项建议。今年,李杰再次关注医药研发问题,提出应加强药品研发知识产权保护,落实药品试验数据保护制度,完善“双首个仿制药”激励制度等建议。
近年来,我国在创新药领域取得了长足进步,2021年,国家药品监督管理局(NMPA)共批准83款新药,其中国产新药51款,较上年呈现出爆发式增长。
李杰认为,伴随着更多企业加大新药研发和投入,药品研发知识产权保护的重要性日渐凸显,与之相匹配的一项重要措施——药品试验数据保护制度也亟待完善。
“新药研发是一个高投入低产出的领域,行业内有3个‘十’的说法,十年研发周期,投资十个亿,仅仅10%的成功率,这其中大量的投入主要是用于药品试验数据的获得,因此这些数据具有很高的经济价值。”李杰说。
在此背景下,李杰建议,以《药品试验数据保护实施办法(暂行)(征求意见稿)》(简称《实施办法》)为基础,增加临床试验数据的保护对象,包括改良型新药,以及凭借自行取得证明药品安全性、有效性试验数据而提出上市申请的仿制药。
“因为只要进行了较大样本量的临床试验,就意味着巨大的时间和经济成本的投入,对相应数据给予保护,可避免他人直接使用其数据‘搭便车’申报,有效保护新药申报者的权益。”李杰说。
他建议,对不同类型的药品设定不同的保护期限。依据《实施办法》,参考美国、日本、欧洲等国家和地区的做法,建议改良型新药设立4年保护期,创新药、儿童药、设立6年保护期,罕见病用药设立7年保护期,创新生物药设立12年保护期,另外基于自行取得的证明药品安全性、有效性的试验数据提出上市申请的仿制药设立4年保护期。
此外,李杰提出完善“双首个仿制药”激励制度。2021年7月4日,《药品专利纠纷早期解决机制实施办法(试行)》(简称《办法》)发布,其中第十一条规定“对首个挑战专利成功并首个获批上市的化学仿制药(双首个仿制药),给予市场独占期,并在该药品获批之日起12个月内不再批准同品种仿制药上市”。
李杰表示,《办法》中的激励制度,对药企加快“双首个仿制药”研发申报的激励效果还不明显。
对此,李杰建议,延长市场独占期。由《办法》中的12个月延长至24个月,让企业能够有更长的时间来消化前期专利挑战和研发的大量投入。同时,国家医疗保障局、国家药品监督管理局、国家知识产权局等相关部门建立联动协调机制,在药品集采和医保谈判的过程中为“双首个仿制药”给予一定的激励政策。
标签:
您可能也感兴趣:
为您推荐
新乡化纤股东中原股权减持1553.97万股 减持套现1.14亿元
合锻智能副总经理孙革因个人原因辞职 王磊接任
新中港董事会秘书王幼妃因退休原因辞职 密志春接任
排行
- 南方中证全指房地产ETF基金净值上涨2.36% 场内价格溢价率为-0.01%
- 华夏中证智能汽车主题ETF基金净值上涨1.29% 场内价格溢价率为-0.02%
- 华夏中证文娱传媒ETF基金净值上涨1.20% 场内价格溢价率为-0.07%
- 国泰中证智能汽车主题ETF基金净值上涨1.32% 场内价格溢价率为0.03%
- 富国中证智能汽车主题ETF基金净值上涨1.35% 场内价格溢价率为-0.15%
- 华宝大数据ETF基金净值上涨1.19% 场内价格溢价率为-0.16%
- 富国中证大数据产业ETF基金净值上涨1.19% 场内价格溢价率为-0.10%
- 鹏华国证证券龙头ETF基金净值上涨1.18% 场内价格溢价率为0.06%
- 鹏华中证800证券保险ETF基金净值上涨1.15% 场内价格溢价率为0.06%
- 华泰柏瑞中证港股通50ETF基金净值上涨1.27% 场内价格溢价率为-0.57%
精彩推送
- 加强药品研发知识产权保护落实药品试验数据保护制度
- 持续推进碳排放市场建设
- 生活服务业数字化提速,2022年北京培育超万家示范门店
- 周鸿祎委员:立足系统思维 建立体系化的安全解决方案
- 九部门:实施“科技援青” 打造世界级盐湖产业基地
- 两部门:开展2022年农村黑臭水体治理试点工作
- 人民银行:我国已初步形成多层次绿色金融产品和市场体系
- 科技部等九部门:支撑云南打造“世界光伏之都”
- 两部门:加强支撑自然资源事业高质量发展的检验检测能力建设
- 统计局:2月下旬重要生产资料市场价格27种涨23种降 液化天然...
- 推进美丽中国建设 我国旗舰物种保护成效显著
- 农业农村部:对农业科创企业支持贷款规模提高至单笔不超1000万元
- 两部门:进一步实施小微企业“六税两费”减免政策
- 不下载APP不给看全文?工信部:立即整改!
- 两部门:进一步实施小微企业“六税两费”减免政策
- 国家统计局:2月下旬液化天然气涨价32.8%
- “雾都”如今“喜阳阳” 重庆“气质”之变从何而来
- 2022年航天科技集团计划安排50余次宇航发射
- 北京“十四五”时期将告别“城市看海”
- “互联网一代”开启新节俭模式
- 在大上海“遇见”小生灵
- 郭卫民:中国经济长期向好基本面没有变
- 人民银行:“一键查卡”服务试点以来已累计提供查询55万次
- 全国政协常委张连起:为吸引人才可降低最高个税边际税率
- 深度合成应用提速 行业治理需多方合力
- 俄富豪6亿美元游艇被德国扣押
- 全国人大代表郑坚江:建议提高多孩家庭个税专项附加扣除标准
- 31省份财政收入: 广东“31连冠”,湖北山西陕西增速前三
- 800件!人民银行完成2021年两会建议提案办理工作
- 下班加油!油价“五连涨”,加满一箱多花10元
- 两部门:减并港口经营服务性收费项目 促进口岸营商环境优化
- 今夜24时油价上调 加满一箱多花10元
- 平安守护 助力抗疫
- 郭卫民:我们有信心、有条件、也有能力实现经济平稳健康可持...
- 探索金融住房租赁新生态 让新市民等群体“住有宜居”
- 什么是SWIFT?禁止使用SWIFT将带来哪些影响?
- 两会前瞻| 今年货币政策将向稳增长倾斜 结构性货币政策工具...
- 2月份我国物流业平稳回升 大宗物资和电商物流需求保持旺盛
- 国家林业和草原局:我国旗舰物种保护取得积极进展
- 2月中国物流业景气指数为51.2% 物流运行将企稳趋升
- 中消协“查验宝”升级 帮助消费者避坑钟表“黑维修”
- 张云明:信息通信业要践行数字责任 赢得发展主动权
- 266家机构调研,科创板动力电池产业链中游企业受关注
- 台湾上午无预警大停电引关注!原因不得而知,网友:不晓得这...
- 机构:稳增长政策促进PMI回升 经济动能有所提振
- 易开户、降费用、守钱袋 人民银行落实惠企利民政策
- 世卫等联合呼吁:停止对配方奶粉进行激进营销
- 动力电池原材料亟需保供稳价
- 禁恶意炒作滥用算法,“弹窗推送”将有规可依
- 针对网络消费纠纷案件,最高法发布司法解释
- 财政提前发力 前两月地方发行新增债券破万亿
- 理解GDP目标增速应契合 可持续发展全局观
- 加快制造业中小企业数字化转型的三大路径
- 2021年《政府工作报告》成绩单出炉:22项量化指标任务全部完成!
- 研究机构发布“双减”成效调查报告: 校外培训负担有...
- 直真科技称“东数西算”工程对业绩影响存在不确定性
- 中科院发布科技支撑“双碳”战略行动计划 面向2060年布局18项...
- 钟正生:内需回暖是拉动制造业PMI上升重要因素
- 破发也传染?北交所开市百天后首现新股破发
- 【两会特稿】艰难的心理咨询
- 国资委:推进央企集团化税务管理,建立税务政策、资源等统筹...
- 俄罗斯最大银行在伦敦暴跌95% 此前宣布退出欧洲市场
- 财联社3月C50风向指数调查:物价续回落 信贷投放或边际走弱
- 全国政协委员刘永好:养猪户在亏损,要鼓励猪肉消费
- 全国政协委员曾毓群:建议建立新型储能容量电价机制
- 10省份最新人口数据:广东增60万,北京常住人口五连降
- 山东自贸试验区青岛片区吹响创新引领号角
- 农业农村部:2022年度国家救灾备荒储备种子5000万公斤
- 两会货币政策前瞻: 降准降息均有可能,贷款利率有望继续下行
- 还清贷款后首付比例及贷款利率可视同“首套房” 郑州打响...
- 国家能源局:1月份全国风电光伏新增装机超过1200万千瓦
- 全国大中型灌区陆续春灌 水利部全面部署春灌调度工作
- 两部门发文:大力表彰在乡村振兴中作出突出贡献的社会组织
- 人勤春早,咱“耕”新啦!
- 报告显示:中国城市科研创新实力快速崛起
- 两会前瞻|今年减税降费规模或在1.5万亿以上,组合式措施或因...
- 国家发改委:强化煤炭市场预期管理 规范价格指数行为
- 经济回升态势强劲 我国PMI连续4个月在50%以上
- 工信部:杜绝随意停限产等“一刀切”行为
- 染缸“出色” 来自浙江柯桥的产业集聚升级调查
- 仅凭一部手机 大湾区施工物资实现“无人购”
- 张忠阳委员:今年中国空间站全面建成 6名航天员将同时在轨
- 二叠纪末大灭绝三大关键因素确认:脱氧、水温升高和酸化
- 我国量子计算云平台 上线两大国产量子编程软件
- 临近财报披露期 变更审计机构要有合理理由
- 上海房贷市场迎春风: 部分银行放款时间缩短、利率下调
- 6000亿元税费缓缴半年 制造业中小微企业获益
- 2月制造业PMI韧性回升 需求稳步回暖带动制造业活动扩张
- 2月制造业PMI为50.2% 环比微升
- 个人经营收款码来啦 对商户和消费者有什么影响?
- 全国两会召开在即,来自上市公司的代表委员提了什么建议
- 科技新高地:大湾区如何利好企业创新升级?
- 国家开始退钱了!有人退了3万5…个税汇算最全攻略来了!网友...
- 国家发展改革委召开电视电话会 部署进一步完善煤炭市场价格...
- 多家航司加征燃油附加费
- 人民银行:2018年以来12次降准 释放长期资金10.3万亿元
- 人民银行:1月债券市场共发行各类债券45119.1亿元
- 2021年度《中国气候公报》发布:去年气象灾害造成直接经济损...
- 十五部门:到2025覆盖城乡的老年健康服务体系基本建立
- 财信研究评2月PMI数据:稳增长政策显效,PMI将稳回扩张区间

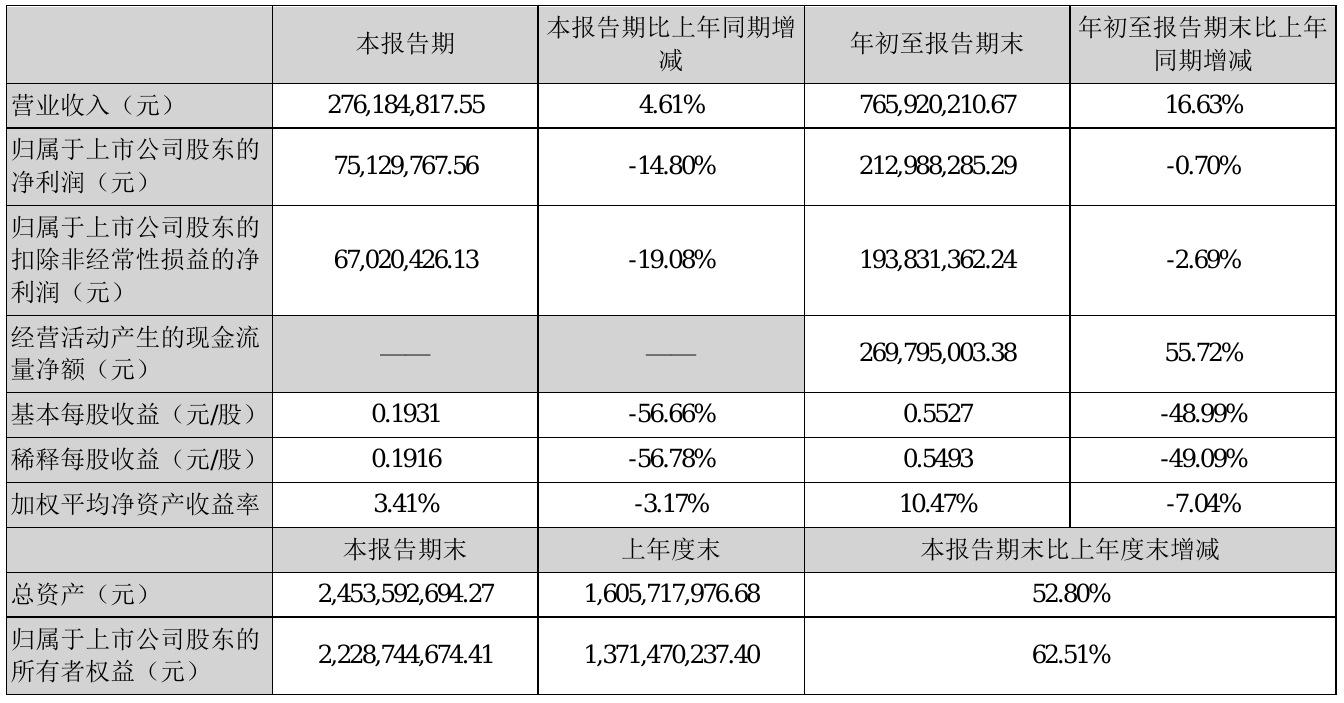
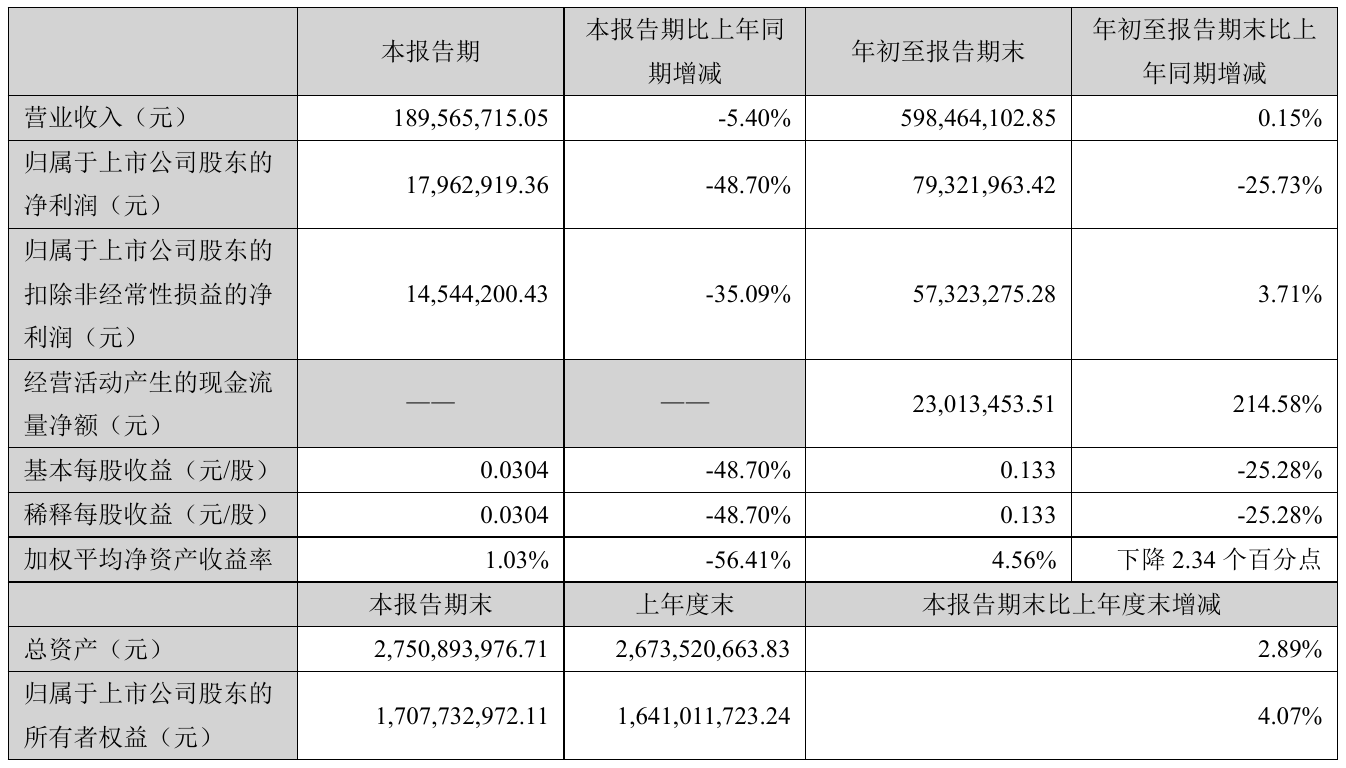

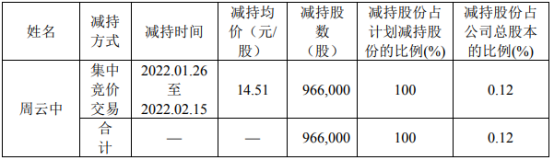



 营业执照公示信息
营业执照公示信息